beryllium sulfide
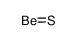
beryllium sulfide结构式

|
常用名 | beryllium sulfide | 英文名 | beryllium sulfide |
|---|---|---|---|---|
| CAS号 | 13598-22-6 | 分子量 | 41.07720 | |
| 密度 | N/A | 沸点 | N/A | |
| 分子式 | BeS | 熔点 | N/A | |
| MSDS | N/A | 闪点 | N/A |
| 英文名 | beryllium sulfide |
|---|---|
| 英文别名 | 更多 |
| 分子式 | BeS |
|---|---|
| 分子量 | 41.07720 |
| 精确质量 | 40.98430 |
| PSA | 32.09000 |
| LogP | 0.64820 |
| 稳定性 | 硫化铍为灰白色粉末,闪锌矿型结晶。相对密度2.36。在空气中略有H2S气味。 |
| 计算化学 | 1.疏水参数计算参考值(XlogP):3.7 2.氢键供体数量:1 3.氢键受体数量:3 4.可旋转化学键数量:1 5.互变异构体数量:无 6.拓扑分子极性表面积42.4 7.重原子数量:25 8.表面电荷:0 9.复杂度:483 10.同位素原子数量:0 11.确定原子立构中心数量:2 12.不确定原子立构中心数量:0 13.确定化学键立构中心数量:0 14.不确定化学键立构中心数量:0 15.共价键单元数量:1 |
制法1用金属铍和硫磺直接反应。
Be+S→BeS
反应装置为一根磨口的石英管,管中部有一个三氧化铝制的舟,中装纯净的金属铍,石英管扩大的一端以备装硫磺,将管倾斜45°角放入一个铂丝炉中,加热至1150℃,用氢气携带着硫磺通过Be,约二小时,即得硫化铍。为了使反应完全,冷却后把管端割掉,取得到的硫化铍,研成细粉末,再次放入舟中,重复通入硫的蒸气处理一次。不过在管子割掉部分一定要熔接一段新的管子以补足其长度。这样在用真空蒸馏除去多余的硫磺后,即可得硫化铍结晶体,纯度可达98%。
制法2 使纯的氯化铍与硫化氢反应可制硫化铍。
BeCl2+H2S→BeS+2HCl
首先制取纯的氯化铍:将HCl气体通过红热的氧化铍和炭的混合物得到氯化铍粗品。在石英管中加热至400℃,使BeCl2升华,反复操作使BeCl2产品尽可能地纯。然后在原装置中通入H2S气体(由H2与S直接制备)。为了避免BeCl2急速升华而损失,需缓慢加热使BeCl2在H2S气体中反复升华几次,得到的BeS起初还会有BeCl2,应将其在850~900℃再与H2S反应1h,这样就可得到白色无定形的较纯硫化铍。
| Beryllium sulfide |
| EINECS 237-064-6 |

