二氧化氯
一般危化品
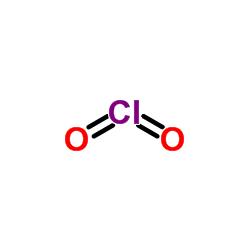
二氧化氯结构式
|
常用名 | 二氧化氯 | 英文名 | Chlorine dioxide |
|---|---|---|---|---|
| CAS号 | 10049-04-4 | 分子量 | 67.452 | |
| 密度 | 3.09g/L | 沸点 | 11°C | |
| 分子式 | ClO2 | 熔点 | -59°C | |
| MSDS | N/A | 闪点 | N/A |
二氧化氯用途【用途一】 用于石油化工厂、合成氨厂和炼油厂等的循环冷却水、宾馆空调冷却水系统的杀菌、灭藻及粘泥剥离 【用途二】
稳定性二氧化氯是新型消毒剂,用于循环水系统,能杀灭水中的微生物、原虫和藻类,并能清除水中的亚硝酸根。用于珍珠养殖业的消毒杀菌。用含20×10-6稳定性二氧化氯的冰块处理对虾,使对虾不会变黑,保鲜效果好。生菜、黄泥螺经其浸泡消毒处理,达到无菌。可用于餐具消毒,冰箱除臭,隐形眼镜片消毒,米糠油净化,汽车除臭消毒。在食品饮料,医院和医药工业中有广泛应用。国外利用载体将稳定性二氧化氯液体制成固体、胶体、颗粒、微胶囊化粉体和缓释型固体,再配以其他辅料。日本已开发了二氧化氯杀菌洗涤剂。 【用途三】 二氧化氯作杀菌剂,可用于鱼类的加工过程,用量为0.05g/kg(水溶液);在蔬、果的保鲜中用量为0.01%。 【用途四】 用于工业水处理,作杀菌消毒剂。亦可作纸浆和纤维的漂白,面粉、油脂、食糖的精练,皮革的脱毛等。 【用途五】 主要用于纸浆和纸、纤维、小麦面粉、淀粉的漂白,油脂、蜂蜡等的精制和漂白。饮用水的消毒杀菌处理。 更多
|
| 中文名 | 二氧化氯 |
|---|---|
| 英文名 | dioxidochlorine(•) |
| 中文别名 | 稳定性二氧化氯水溶液 |
| 英文别名 | 更多 |
| 密度 | 3.09g/L |
|---|---|
| 沸点 | 11°C |
| 熔点 | -59°C |
| 分子式 | ClO2 |
| 分子量 | 67.452 |
| 精确质量 | 66.958679 |
| PSA | 34.14000 |
| LogP | 0.45190 |
| 外观性状 | 气体 |
| 储存条件 | 1.库房低温通风干燥; 防火, 防高温, 轻搬轻放, 与氧化剂, 食品原料分开存放. 二氧化氯气体如受热和受光照,能促进分解和引起爆炸,一般不宜长途运输,若用户(如造纸厂和自来水长等)需要,则自产自用。 |
| 稳定性 | 1.与水, 或水蒸汽反应生成有毒腐蚀性氯化氢气体; 与非金属, 如磷, 硫等, 燃烧; 热分解有毒氯化物烟雾 2.遇热水则分解成次氯酸、氯气、氧气,受光也易分解,其溶液于冷暗处十分稳定。二氧化氯受热和受光照或遇有机物等能促进氧化作用的物质时,能促进分解并易引起爆炸。若用空气、二氧化碳、氮气等惰性气体稀释时,爆炸性则降低。属强氧化剂,其有效氯是氯的2.6倍。与很多物质都能发生剧烈反应。腐蚀性很强。 |
| 水溶解性 | Soluble ºC |
| 计算化学 | 1.疏水参数计算参考值(XlogP):1.4 2.氢键供体数量:0 3.氢键受体数量:1 4.可旋转化学键数量:0 5.互变异构体数量:无 6.拓扑分子极性表面积18.1 7.重原子数量:3 8.表面电荷:0 9.复杂度:7.5 10.同位素原子数量:0 11.确定原子立构中心数量:0 12.不确定原子立构中心数量:0 13.确定化学键立构中心数量:0 14.不确定化学键立构中心数量:0 15.共价键单元数量:1 |
| 更多 | 1. 性状:黄绿色或黄红色气味。有类似氯气和硝酸的特殊刺激臭味。液体为红褐色,固体为橙红色。 2. 气体密度:3.09g/L 3. 熔点(ºC):-59 4. 沸点(ºC,常压):11 5. 溶解性:易溶于水,溶于碱溶液、硫酸。 |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
二氧化氯毒理学数据: 口服-大鼠 LD50: 292 毫克/公斤; 吸入-大鼠 LDL0: 500 PPM/15分,对呼吸器官黏膜和眼有刺激作用。 对人体有害,其毒性与氯气相似,能侵蚀眼睛和呼吸器官。在浓度含量高的情况下,侵入中枢神经使人致死。在空气中容许浓度为0.3mg/m3。如已吸入时,立即移送到清净的空气中。如不慎溅入眼睛,用水充分冲洗干净。 工作前必须穿戴工作服、橡皮围裙、乳胶手套、个人专用的保护面具。在工作时,要求生产设备密闭,通风良好。下班后,务必淋浴。 |
| 危害码 (欧洲) | O: Oxidizing agent;T+: Very toxic;N: Dangerous for the environment; |
|---|---|
| 风险声明 (欧洲) | R6 |
| 安全声明 (欧洲) | S23-S26-S28-S36/37/39-S38-S45-S61 |
| 危险品运输编码 | UN 9191 |
| 二氧化氯上游产品 10 | |
|---|---|
| 二氧化氯下游产品 10 | |
1.稳定性二氧化氯的生产,由于生产工艺和选用原料不同,有许多方法。大体上都是首先制备较高纯度的二氧化氯,然后把二氧化氯吸收到含稳定剂的水溶液中,生成稳定性二氧化氯水溶液。近年来,美国和日本等相继开发了固体二氧化氯。
硫酸-氯酸钠法将氯酸钠和氯化钠的摩尔比为1:1.05的混合水溶液加入反应器,再加入98%硫酸,于35℃下进行反应,生成的二氧化氯和氯气,由通入空气驱出。把反应生成的二氧化氯和氯气的混合气体送入二氧化氯吸收塔,用含稳定剂的水溶液对流吸收,生成稳定性二氧化氯水溶液。其
未溶的氯气则进入氯气吸收塔,用碱液吸收生成次氯酸钠。
盐酸一亚氯酸钠法将亚氯酸钠溶解于水中配成适当浓度的溶液加入反应器中,把盐酸按适当配料比在搅拌下加入反应器中进行反应,生成的二氧化氯气体,由通入空气驱出。把生成的二氧化氯气体送人二氧化氯吸收塔,用含稳定剂的水溶液对流吸收,生成稳定性二氧化氯水溶液。其
吸附法用硅酸钙、分子筛、硅胶等多孔性物质作为吸附剂,吸附溶液中的二氧化氯后变成固体二氧化氯。
2.以氯酸盐为原料,在酸性介质中还原制得二氧化氯,由于还原剂的不同,又可分为:1.二氧化硫法,其中有新马蒂逊法、新大曹法;2.盐酸法,其中有开斯汀法;3.食盐法,其中有R2法、R3法(SVP法)。目前工业生产应用较多的方法有新马蒂逊法,R2法、R3法、开斯汀法。R8法是80年代中期开发的新方法。
(1)新马蒂逊法 将含600 g/L氯酸钠溶液与95%~98%硫酸连续定量地送入反应器,经空气稀释的5%~8%二氧化硫气体通过气体分布板进入反应器。反应器有两个,第一反应器于30~40℃进行反应,而反应大部分在此完成,使用第二反应器可以提高氯酸钠的利用率。反应器产生的气体送到洗气器中,二氧化氯气体送入吸收塔用冷水吸收,制成6~8 g/L二氧化氯水溶液。第二反应器溢流出的废液进入气提塔,从塔底通入少量空气,以提出溶解在溶液中的二氧化氯,气体通过洗气塔进入二氧化氯吸收塔,用冷水吸收,制成二氧化氯水溶液。从气提塔排出废液可回收利用。其
(2)开斯汀法用盐酸还原氯酸钠制得二氧化氯和氯化钠,把氯化钠再电解制成氯酸钠。
从电解槽出来的溶液含氯酸钠360~400g/L,氯化钠80~100 g/L,与32%盐酸同时加入第一反应器,溢流通过至第六反应器,反应器温度分别为20、40、60、80、100、103℃,使盐酸与氯酸钠充分反应。从最后第三个反应器通人空气,搅拌反应溶液,并稀释反应生成的二氧化氯气体,经二氧化氯吸收塔用冷水吸收生成二氧化氯水溶液。未被吸收的氯气用碱液吸收,制成次氯酸钠溶液。其
(3)R2法将氯酸钠和氯化钠的摩尔比为1:1.05的混合水溶液加入反应器,再加入98%硫酸,于35~55℃进行反应,生成的二氧化氯和氯气由通入空气驱出。把反应生成的二氧化氯和氯气的混合气体进入二氧化氯吸收塔,用水对流吸收,生成二氧化氯水溶液,而未溶的氯气则进入氯气吸收塔,用碱液吸收生成次氯酸钠。其
气提塔排出的废液,含有芒硝和硫酸,可供牛皮纸浆生产之用。
(4)R3法本法生产二氧化氯的反应与R2法基本相同。其关键是独特的二氧化氯发生器,它在减压时可得到浓度为36%的产品。在普通常压法中这样的浓度会爆炸。发生器底部流出的反应生成液中的硫酸钠晶体淤浆与氯酸钠和氯化钠混合进料,再煮沸,与硫酸进一步混合,从顶部送入发生器。反应产生的二氧化氯和氯气被少量空气稀释后,一起流入冷凝器,经冷却后进人吸收塔。生成二氧化氯溶液含C1O2 8g/L。其
为了防止爆炸,整个系统压力维持在26.66~39.99 kPa的低压,这样就保持混合物的稳定性。
(5)R8法本法与R3法基本相同,使用甲醇作为还原剂生产二氧化氯,副产的芒硝产量比R3法要少。
把原料工业氯酸钠、发烟硫酸、甲醇和氯化钠在特制容器(反应——蒸发——结晶为一体的单元反应器)二氧化氯发生器中,当系统温度(70±4)℃,在13.32 kPa减压下,反应介质酸度控制4~5 mol,氯酸钠与甲醇摩尔比约4:l时,反应产生的二氧化氯,流人冷凝器,经冷却后进入二氧化氯吸收塔,生成二氧化氯溶液含C1O2 8~10 g/L。其
| dioxidochlorine(.) |
| Anthium dioxcide |
| Caswell No. 179A |
| Chlorine peroxide |
| Doxcide 50 |
| Chloroperoxyl |
| chloride dioxide |
| Chlorosyloxidanyl |
| CHLORINE DIOXIDE |
| ClO2(.) |
| Chloranyl, dioxido- |
| EINECS 233-162-8 |
| chlorine oxide |
| Chloryl radical |
| chlorine dioxine |
| Chlorine(IV) oxide |
| chlorosyloxy |
| Alcide |
| OClO radical |
| MFCD01732063 |
| Dioxido-λ-chloranyl |
| Chlorine oxide (ClO2) |

 CAS号7758-19-2
CAS号7758-19-2 CAS号14998-27-7
CAS号14998-27-7 CAS号13898-47-0
CAS号13898-47-0 CAS号7790-93-4
CAS号7790-93-4 CAS号7782-50-5
CAS号7782-50-5 CAS号10028-15-6
CAS号10028-15-6 CAS号3811-04-9
CAS号3811-04-9 CAS号7664-93-9
CAS号7664-93-9 CAS号21351-39-3
CAS号21351-39-3 CAS号14866-68-3
CAS号14866-68-3 CAS号7726-95-6
CAS号7726-95-6 CAS号15070-13-0
CAS号15070-13-0 CAS号7789-59-5
CAS号7789-59-5 CAS号14314-27-3
CAS号14314-27-3 CAS号14380-61-1
CAS号14380-61-1 CAS号80937-33-3
CAS号80937-33-3 CAS号10026-13-8
CAS号10026-13-8





