氮气
一般危化品

氮气结构式
|
常用名 | 氮气 | 英文名 | Nitrogen |
|---|---|---|---|---|
| CAS号 | 7727-37-9 | 分子量 | 28.01340 | |
| 密度 | 1.2506 | 沸点 | −196 °C(lit.) | |
| 分子式 | N2 | 熔点 | −210 °C(lit.) | |
| MSDS | N/A | 闪点 | N/A |
氮气用途用途一:用于制硝酸、合成氨、氰氨化钙、炸药等 用途二:用于电器、食品包装充填气、半导体器件制备工艺中热氧化、外延扩散、化学气相沉积等,还可用于气相色谱仪 用途三:用于稀有气体的提取冷冻、仪器或机件深冷处理等
用途四:可供大规模集成电路作保护气,用作灯泡充填气等 用途五:空气和氧气分散剂。 用途六:制冷剂,可作为食品急速冻结的直接冷媒;包装用气体(用以置换包装容器中的残留空气,以延长保存期)。用量均视正常生产需要而定(FAO/WHO,2001)GB 2760—1996列为食品加工助剂。 用途七:化学工业用于合成氨、硝酸、氰氨化钙、氰化物、过氧化氢等生产。纯氮气用作防止氧化、挥发、易燃物质的保护气体、灯泡填充气。液氮主要用作冷源,用于仪器或机件的深度冷冻处理及食品速冻。也用于低温微粉碎用及电子工业等。 用途八:用于化肥,医药,畜牧,冷藏和电子工业等。 用途九:用于金属冶炼、化工、机械加工等行业 更多
|
||||
氮气作用植物缺氮状态 氮是植物生长的必需养分之一,它是每个活细胞的组成部分。植物需要大量氮。 氮素是叶绿素的组成成分,叶绿素a和叶绿素ß都是含氮化合物。绿色植物进行光合作用,使光能转变为化学能,把无机物(二氧化碳和水)转变为有机物(葡萄糖)是借助于叶绿素的作用。葡萄糖是植物体内合成各种有机物的原料,而叶绿素则是植物叶子制造“粮食”的工厂。氮也是植物体内维生素和能量系统的组成部分。
氮素对植物生长发育的影响是十分明显的。当氮素充足时,植物可合成较多的蛋白质,促进细胞的分裂和增长,因此植物叶面积增长炔,能有更多的叶面积用来进行光合作用。 此外,氮素的丰缺与叶子中叶绿素含量有密切的关系。能从叶面积的大小和叶色深浅上来判断氮素营养的供应状况。在苗期,一般植物缺氮往往表现为生长缓慢,植株矮小,叶片薄而小,叶色缺绿发黄。禾本科作物则表现为分孽少。生长后期严重缺氮时,则表现为穗短小,籽粒不饱满。在增施氮肥以后,对促进植物生长健壮有明显的作用。往往施用后,叶色很快转绿,生长量增加。但是氮肥用量不宜过多,过量施用氮素时,叶绿素数量增多,能使叶子更长久地保持绿色,以致有延长生育期、贪青晚熟的趋势。对一些块根、块茎作物,如糖用甜菜,氮素过多时,有时表现为叶子的生长量显著增加,但具有经济价值的块根产量却少得使人失望。 元素固定 由于氮是一种重要肥料,所以把氮气转化为氮的化合物的方法叫做氮的固定。主要用于农业上。又分生物、自然、人工固氮3种。 一种固氮的方式是利用植物的根瘤菌根瘤菌是一种细菌,能使豆科植物的根部形成根瘤在自然条件下,它能把空气中的氮气转化为含氮的化合物供植物利用。“种豆子不上肥,连种几年地更肥”就是讲的这个道理。 更多
|
| 中文名 | 高纯氮 |
|---|---|
| 英文名 | dinitrogen |
| 中文别名 | 氮气 | 氮 | 液氮 | 纯氮 |
| 英文别名 | 更多 |
| 密度 | 1.2506 |
|---|---|
| 沸点 | −196 °C(lit.) |
| 熔点 | −210 °C(lit.) |
| 分子式 | N2 |
| 分子量 | 28.01340 |
| 精确质量 | 28.00610 |
| PSA | 47.58000 |
| LogP | 0.03016 |
| 外观性状 | 无色,无气味的气体 |
| 蒸汽密度 | 0.97 (vs air) |
| 储存条件 | 储存注意事项储存于阴凉、通风的不燃气体专用库房。远离火种、热源。库温不宜超过30℃。储区应备有泄漏应急处理设备。 |
| 稳定性 | 1.常温下化学性质稳定,加热至560℃时,能被镁、钙、锂和另外一些金属所吸收。在更高温度下能直接与氧和氢化合。溶于水(0℃时2.33cm3/100ml水,40℃时1.42cm3/100ml水),微溶于醇。液化温度77.35k,固化温度63.2k。无色无嗅的气体,在水中的溶解度很小,在室温下化学性质为惰性,但可被碳吸收。 2.稳定性 稳定 3.聚合危害不聚合 |
| 分子结构 | 1、摩尔折射率:3.87 2、摩尔体积(cm3/mol):31.9 3、等张比容(90.2K):70.5 4、表面张力(dyne/cm):23.6 5、极化率(10-24cm3):1.53 |
| 计算化学 | 1.疏水参数计算参考值(XlogP):0.1 2.氢键供体数量:0 3.氢键受体数量:2 4.可旋转化学键数量:0 5.互变异构体数量:无 6.拓扑分子极性表面积47.6 7.重原子数量:2 8.表面电荷:0 9.复杂度:8 10.同位素原子数量:0 11.确定原子立构中心数量:0 12.不确定原子立构中心数量:0 13.确定化学键立构中心数量:0 14.不确定化学键立构中心数量:0 15.共价键单元数量:1 |
| 更多 | 1.性状:无色无味压缩气体 2.熔点(℃):-209.9 3.沸点(℃):-196 4.相对密度(水=1):0.81(-196℃) 5.相对蒸气密度(空气=1):0.97 6.饱和蒸气压(kPa):1026.42(-173℃) 7.临界温度(℃):147.1 8.临界压力(MPa):3.40 9.辛醇/水分配系数:0.67 10.溶解性:微溶于水、乙醇,溶于液氨。 |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 安全声明 (欧洲) | S38 |
|---|---|
| 危险品运输编码 | UN 1066 2.2 |
| WGK德国 | - |
| RTECS号 | QW9700000 |
| 危险类别 | 2.2 |
| 海关编码 | 2804300000 |
1.空分法 采用全低压流程,首先清除空气中灰尘和机械杂质,然后在压缩机中压缩,清除压缩空气中二氧化碳,干燥压缩空气,经液化、精馏,分离成氧和氮气。氮气贮藏在氮气柜;液氮送入贮槽,压缩的氮气充填氮气瓶中。
图XV-1 NaN3分解装置 利用活性铜提纯氮气装置
2.在如图所示的装置中,向长为40cm,直径为2cm的玻璃制分解管中装填数毫米厚,经重结晶并干燥的NaN3。磨口接头用湿布包裹使之冷却。用高真空泵将整个装置抽成真空,在保持真空下进行加热干燥。但装有NaN3的那根玻璃管不能加热到NaN3分解的温度。用高频真空检漏器检测系统是否漏气。这样做之后,用火焰均匀地加热管1。关闭活塞3,从一头依序将NaN3加热至开始分解。加热一段时间后停止加热,关闭活塞4和5,打开活塞3后,当确定压力计6的压力在增加,说明气体还在继续生成,当压力增加缓慢时,应再加热。如此继续操作直到在压力计上可以看到烧瓶中有了一些压力,制取了足够量的气体为止。当钠的细尘在烧瓶7中落下后,就可让气体进入烧瓶8。不要用玻璃棉来挡住钠的细尘。此操作不会有爆炸的危险,因为即使压力突然增加,最坏的结果也只不过是在2处将磨口冲开而已。此法制得的氮气已经很纯,无需再加纯制。NaN3的分解温度为280℃,KN3为360℃。
3.由钢瓶氮气纯制:钢瓶氮气中的水蒸气和CO2等杂质可用通常的洗涤剂除去,但除去痕量的氧气很困难。如需要高纯度的氮气最好选用下述的方法:装置如图,将长度为10m,电阻为64Ω的电热线直接缠绕在一根长75cm,直径4cm的玻璃管上。利用调压变压器将管子内的温度调节到约170℃。内管的外面再套上一个玻璃管以减少热量损失,同时试验时也可以观察内管中的现象。在内管中密封填充物,然后从内管的上面通入氢气,确认其中的空气被驱净后,即可通电加热。把还原CuO所生成的水从活塞中放走。当填充物全部变成暗紫色后,即可停止氢气,通入待纯制的氮气,填充物可用下列方法制得:
将120g Cu(OH)2CuCO3溶于2L浓氨水中,加入用盐酸洗过并经灼烧过的硅藻土420g,在水浴上蒸干。将其粉碎成3~5mm大小,在150~180℃彻底干燥至颗粒呈现棕色光泽。筛去细粉,得到产品。
图NaN3分解装置利用活性铜提纯氮气装置
1—加热管;2—磨口活塞;3,4,5—活塞;6—压力计;7,8—烧瓶2将250g CuCl2·H2O(或366g CuSO4·5H2O)溶于2L水中。加入用盐酸煮过并经过灼烧的硅藻土250g,加热至60℃,并在猛力搅拌下,将200g NaOH溶于500mL水的60℃溶液加入,10min后,将它倾入10L蒸馏水中。放置沉降,倾去上层清液,用蒸馏水用倾析法反复洗涤多次后抽吸过滤。将滤饼在螺旋手压机中压成3~5mm的细条,晾至半干后切成5~10mm细段,在180℃下烘干至恒重。
高纯氮一般以空气分离装置生产的氮气作为原料,通过化学法、吸附干燥法、变压吸附法及膜分离法等净化制成。
| 海关编码 | 2804300000 |
|---|
| MFCD00011416 |
| EINECS 231-783-9 |
| molecular nitrogen |
| Nitrogen |

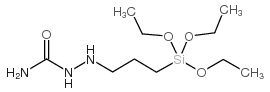 CAS号106868-88-6
CAS号106868-88-6 CAS号54-85-3
CAS号54-85-3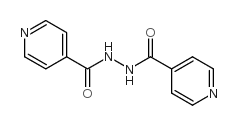 CAS号4329-75-3
CAS号4329-75-3 CAS号38634-05-8
CAS号38634-05-8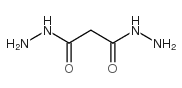 CAS号3815-86-9
CAS号3815-86-9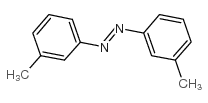 CAS号588-04-5
CAS号588-04-5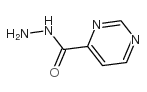 CAS号39513-54-7
CAS号39513-54-7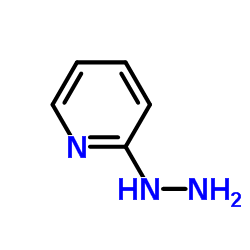 CAS号4930-98-7
CAS号4930-98-7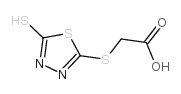 CAS号53723-88-9
CAS号53723-88-9