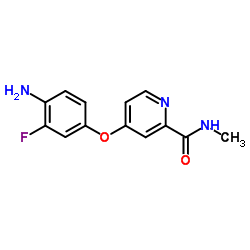
N-[3-叔丁基-1-(喹啉-6-基)-1H-吡唑-5-基]-N'-[2-氟-4-[(2-(甲基氨基甲酰基)吡啶-4-基)氧]苯基]脲
![N-[3-叔丁基-1-(喹啉-6-基)-1H-吡唑-5-基]-N'-[2-氟-4-[(2-(甲基氨基甲酰基)吡啶-4-基)氧]苯基]脲结构式](https://image.chemsrc.com/caspic/125/1020172-07-9.png)
N-[3-叔丁基-1-(喹啉-6-基)-1H-吡唑-5-基]-N'-[2-氟-4-[(2-(甲基氨基甲酰基)吡啶-4-基)氧]苯基]脲结构式

|
常用名 | N-[3-叔丁基-1-(喹啉-6-基)-1H-吡唑-5-基]-N'-[2-氟-4-[(2-(甲基氨基甲酰基)吡啶-4-基)氧]苯基]脲 | 英文名 | DCC-2036 (Rebastinib) |
|---|---|---|---|---|
| CAS号 | 1020172-07-9 | 分子量 | 553.587 | |
| 密度 | 1.3±0.1 g/cm3 | 沸点 | 666.8±55.0 °C at 760 mmHg | |
| 分子式 | C30H28FN7O3 | 熔点 | N/A | |
| MSDS | N/A | 闪点 | 357.0±31.5 °C |
用途Rebastinib (DCC-2036) 是一种 Bcr-Abl 抑制剂抑制剂,作用于 Abl1WT 和 Abl1T315I,IC50 分别为 0.8 nM 和 4 nM,也抑制SRC,KDR,FLT3 和 Tie-2,低活性作用于c-Kit。 |
||||
作用1. 体外活性: DCC-2036对野生型或突变型BCR-ABL1的Ba/F3细胞有抗增殖活性(IC50:2-150 nM)。此外,DCC-2036对Ph+细胞系K562增殖也有抑制作用(IC50:5.5 nM),并有效诱导表达BCR-ABL1的Ba/F3和K562细胞凋亡。 通过对CML细胞系的显著抑制(与非CML白血病细胞系相比),DCC-2036可选择性抑制BCR-ABL阳性细胞。DCC-2036对纯化的未磷酸化和磷酸化ABL1(IC50:0.8/2 nM)、未磷酸化和磷酸化突变型ABL1T315I(IC50:1.4/5 nM)及激活环突变ABL1H396P(IC50:4 nM)呈较强的非ATP竞争性抑制作用。DCC-2036还抑制SRC家族激酶SRC/LYN/FGR/HCK及受体 TKs KDR/FLT3/TIE2(IC50:34/29/38/40/4/2/6 nM)。 2. 体内活性: 给在携带Ba/F3-BCR-ABL1T315I白血病细胞的小鼠移植瘤模型中,DCC-2036(100 mg/kg/day,p.o.)对BCR-ABL1信号具有明显抑制效果,并显著延长小鼠寿命。 |
| 中文名 | N-[3-叔丁基-1-(喹啉-6-基)-1H-吡唑-5-基]-N'-[2-氟-4-[(2-(甲基氨基甲酰基)吡啶-4-基)氧]苯基]脲 |
|---|---|
| 英文名 | 4-[4-[(5-tert-butyl-2-quinolin-6-ylpyrazol-3-yl)carbamoylamino]-3-fluorophenoxy]-N-methylpyridine-2-carboxamide |
| 英文别名 | 更多 |
| 描述 | Rebastinib (DCC-2036) 是一种 Bcr-Abl 抑制剂抑制剂,作用于 Abl1WT 和 Abl1T315I,IC50 分别为 0.8 nM 和 4 nM,也抑制SRC,KDR,FLT3 和 Tie-2,低活性作用于c-Kit。 |
|---|---|
| 相关类别 | |
| 靶点 |
IC50: 0.75±0.11 nM (ABL1WT), 2±0.3 nM (FLT3), 4±0.3 nM (KDR), 6±0.3 nM (TIE2), 34±6 nM (SRC)[1] |
| 体外研究 | Rebastinib(DCC-2036)抑制ABL1native和网守突变体ABL1T315I,IC50分别为0.8 nM和4 nM。 Rebastinib有效(IC50 0.82 nM)抑制u-ABL1native,其被认为主要存在于无活性的II型构象中。此外,Rebastinib还强烈抑制p-ABL1native(IC50 2 nM),后者更容易采用活性的I型构象。更重要的是,Rebastinib有效抑制u-ABL1T315I(IC50 5 nM)和p-ABL1T315I(IC50 4 nM),由于T315I突变使活化的疏水性脊柱稳定,两者都主要以I型构象存在。 Rebastinib也有效抑制ABL1H396P(IC50 1.4 nM),与ABL1T315I一样,由于突变体Pro396强加的骨架扭转角受限,因此易于主要以I型激活构象存在。除ABL1外,Rebastinib还抑制SRC家族激酶LYN,SRC,FGR和HCK,PDGFRα和PDGFRβ,IC50为29±1,34±6,38±1,40±1,70±10和113分别为±10 nM。值得注意的是,Rebastinib保留了c-KIT(IC50 481 nM)。 Rebastinib有效抑制表达天然BCR-ABL1native的Ba/F3细胞的增殖(IC50 5.4nM)。 Rebastinib还抑制Ph +细胞系K562的增殖(IC50 5.5nM)。 REBASTINIB(DCC-2036)还抑制BCR-ABL1的几种常见TKI抗性突变体的增殖,包括G250E,Q252H,Y235F,E255K,V299L,F317L和M351T,IC50范围为6-150nM。 Rebastinib有效抑制BCR-ABL1native(IC50 29 nM)和BCR-ABL1T315I(IC50 18 nM)的自身磷酸化,以及两种细胞系中STAT5的磷酸化(IC50分别为28 nM和13 nM)[1]。 |
| 体内研究 | 单次口服剂量的Rebastinib(DCC-2036)100 mg/kg可提供超过12μM的循环血浆水平长达24小时(数据未显示),并有效抑制BCR-ABL1信号传导长达8小时的Ba /从BM和携带荷瘤小鼠的脾分离的F3-BCR-ABL1T315I白血病细胞,通过磷酸-STAT5的细胞内流式细胞术染色和磷酸-BCR-ABL1和磷酸-STAT5的组织提取物的免疫印迹评估。用口服强饲法以100mg/kg每天一次用Rebastinib治疗携带Ba/F3-BCR-ABL1T315I白血病细胞的小鼠显着延长其存活,而每天两次100mg/kg的伊马替尼是无效的。在这种侵袭性的同种异体移植模型中,Rebastinib(DCC-2036)对治疗BCR-ABLT315I白血病同样有效,因为每天两次100 mg/kg的伊马替尼用于治疗BCR-ABL1native白血病,并减少白血病细胞在脾脏中的负担。治疗小鼠[1]。 |
| 激酶实验 | 来自患有复发和难治性Ph + B-ALL和可检测的T315I突变(等位基因频率40%)的患者的外周血原始细胞在补充有100μM2-巯基乙醇和0.5%BSA的IMDM中孵育过夜(初始细胞存活率> 90%),并且无药物或伊马替尼(1μM)或瑞巴斯替尼(DCC-2036)(50,200和1000 nM)。温育后,裂解细胞,并如上所述对蛋白质提取物进行免疫印迹分析。将患有慢性期CML和L298V突变的患者的外周血单核细胞(7.5×105)在不同浓度的Rebastinib(DCC-2036)或DMSO中孵育3小时,然后进行裂解和免疫印迹分析[1]。 |
| 细胞实验 | 将Ba / F3细胞(3×103细胞/孔)或原代Ph +白血病细胞(5×10 4细胞/孔)一式三份铺板于含有测试化合物(例如,Rebastinib(DCC-2036))的96孔板中。 72小时后,通过刃天青或MTT测定法定量活细胞。结果代表至少三次独立实验的平均值[1]。 |
| 动物实验 | 小鼠[1]通过用BCR-ABL1native或BCR-ABL1T315I逆转录病毒转导而转化为白细胞介素-3独立性的Ba / F3细胞(1×106)被静脉内注射到同系Balb / c受体中。注射后第3天开始,给予小鼠伊马替尼(100 mg / kg水,每日两次,通过口服强饲)或瑞巴司他(DCC-2036)(100 mg / kg,0.5%CMC / 1%Tween-80,一次)每日通过口服强饲法)或仅用载体(0.5%CMC / 1%吐温-80)。为了诱导CML样白血病,静脉注射150mg / kg 5-氟尿嘧啶(5-FU),用BCR-ABL1T315I逆转录病毒转导后4天收获雄性Balb / c供体小鼠的骨髓(BM),和5×将105个细胞静脉内注射到经亚致死剂量照射的(400cGy)Balb / c受体中。从移植后第5天开始,通过单独载体或Rebastinib(DCC-2036)以100mg / kg口服强饲法每天一次治疗组群。对于B细胞急性淋巴细胞白血病的诱导,来自未用5-FU预处理的供体的BM用BCR-ABL1T315I逆转录病毒转导一次,并将1×106细胞注射到经亚致死照射的Balb / c受体中。从移植后第8天开始,每天通过口服管饲法单独使用载体,每天两次,使用Rebastinib(DCC-2036),60 mg / kg,伊马替尼100 mg / kg(水中),或达沙替尼10 mg / kg(在80mM柠檬酸pH 3.1中)。 |
| 参考文献 |
| 密度 | 1.3±0.1 g/cm3 |
|---|---|
| 沸点 | 666.8±55.0 °C at 760 mmHg |
| 分子式 | C30H28FN7O3 |
| 分子量 | 553.587 |
| 闪点 | 357.0±31.5 °C |
| 精确质量 | 553.223755 |
| PSA | 126.55000 |
| LogP | 4.90 |
| 外观性状 | 白色至类白色固体 |
| 蒸汽压 | 0.0±2.0 mmHg at 25°C |
| 折射率 | 1.655 |
| 储存条件 | -20℃ |
|
~45% ![N-[3-叔丁基-1-(喹啉-6-基)-1H-吡唑-5-基]-N'-[2-氟-4-[(2-(甲基氨基甲酰基)吡啶-4-基)氧]苯基]脲结构式](https://image.chemsrc.com/caspic/125/1020172-07-9.png)
N-[3-叔丁基-1-(喹啉-... 1020172-07-9 |
| 文献:DECIPHERA PHARMACEUTICALS, LLC; FLYNN, Daniel L.; PETILLO, Peter A.; KAUFMAN, Michael D. Patent: WO2013/36232 A2, 2013 ; Location in patent: Paragraph 00358 ; |
|
~% ![N-[3-叔丁基-1-(喹啉-6-基)-1H-吡唑-5-基]-N'-[2-氟-4-[(2-(甲基氨基甲酰基)吡啶-4-基)氧]苯基]脲结构式](https://image.chemsrc.com/caspic/125/1020172-07-9.png)
N-[3-叔丁基-1-(喹啉-... 1020172-07-9 |
| 文献:WO2013/36232 A2, ; |
|
~% ![N-[3-叔丁基-1-(喹啉-6-基)-1H-吡唑-5-基]-N'-[2-氟-4-[(2-(甲基氨基甲酰基)吡啶-4-基)氧]苯基]脲结构式](https://image.chemsrc.com/caspic/125/1020172-07-9.png)
N-[3-叔丁基-1-(喹啉-... 1020172-07-9 |
| 文献:WO2013/36232 A2, ; |
|
~% ![N-[3-叔丁基-1-(喹啉-6-基)-1H-吡唑-5-基]-N'-[2-氟-4-[(2-(甲基氨基甲酰基)吡啶-4-基)氧]苯基]脲结构式](https://image.chemsrc.com/caspic/125/1020172-07-9.png)
N-[3-叔丁基-1-(喹啉-... 1020172-07-9 |
| 文献:WO2013/36232 A2, ; |
|
~% ![N-[3-叔丁基-1-(喹啉-6-基)-1H-吡唑-5-基]-N'-[2-氟-4-[(2-(甲基氨基甲酰基)吡啶-4-基)氧]苯基]脲结构式](https://image.chemsrc.com/caspic/125/1020172-07-9.png)
N-[3-叔丁基-1-(喹啉-... 1020172-07-9 |
| 文献:WO2013/36232 A2, ; |
|
~% ![N-[3-叔丁基-1-(喹啉-6-基)-1H-吡唑-5-基]-N'-[2-氟-4-[(2-(甲基氨基甲酰基)吡啶-4-基)氧]苯基]脲结构式](https://image.chemsrc.com/caspic/125/1020172-07-9.png)
N-[3-叔丁基-1-(喹啉-... 1020172-07-9 |
| 文献:WO2013/36232 A2, ; |
|
~% ![N-[3-叔丁基-1-(喹啉-6-基)-1H-吡唑-5-基]-N'-[2-氟-4-[(2-(甲基氨基甲酰基)吡啶-4-基)氧]苯基]脲结构式](https://image.chemsrc.com/caspic/125/1020172-07-9.png)
N-[3-叔丁基-1-(喹啉-... 1020172-07-9 |
| 文献:WO2013/36232 A2, ; |
|
~% ![N-[3-叔丁基-1-(喹啉-6-基)-1H-吡唑-5-基]-N'-[2-氟-4-[(2-(甲基氨基甲酰基)吡啶-4-基)氧]苯基]脲结构式](https://image.chemsrc.com/caspic/125/1020172-07-9.png)
N-[3-叔丁基-1-(喹啉-... 1020172-07-9 |
| 文献:WO2013/36232 A2, ; |
|
~% ![N-[3-叔丁基-1-(喹啉-6-基)-1H-吡唑-5-基]-N'-[2-氟-4-[(2-(甲基氨基甲酰基)吡啶-4-基)氧]苯基]脲结构式](https://image.chemsrc.com/caspic/125/1020172-07-9.png)
N-[3-叔丁基-1-(喹啉-... 1020172-07-9 |
| 文献:WO2013/36232 A2, ; |
| N-[3-tert-Butyl-1-(quinolin-6-yl)-1H-pyrazol-5-yl]-N'-[2-fluoro-4-[(2-(methylcarbamoyl)pyridin-4-yl)oxy]phenyl]urea |
| DCC2036 |
| 2-Pyridinecarboxamide, 4-[4-[[[[3-(1,1-dimethylethyl)-1-(6-quinolinyl)-1H-pyrazol-5-yl]amino]carbonyl]amino]-3-fluorophenoxy]-N-methyl- |
| Rebastinib |
| 4-[3-Fluoro-4-({[3-(2-methyl-2-propanyl)-1-(6-quinolinyl)-1H-pyrazol-5-yl]carbamoyl}amino)phenoxy]-N-methyl-2-pyridinecarboxamide |
| 4-[4-({[3-Tert-Butyl-1-(Quinolin-6-Yl)-1h-Pyrazol-5-Yl]carbamoyl}amino)-3-Fluorophenoxy]-N-Methylpyridine-2-Carboxamide |
| Rebastinib [USAN] |
| 1-(3-tert-butyl-1-(quinolin-6-yl)-1H-pyrazol-5-yl)-3-(2-fluoro-4-(2-(methylcarbamoyl)pyridin-4-yloxy)phenyl)urea |
| 4-(4-(3-(3-tert-butyl-1-(quinolin-6-yl)-1H-pyrazol-5-yl)ureido)-3-fluorophenoxy)-N-methylpicolinamide |
| DP-1919 |
| DCC-2036 |