| 描述 |
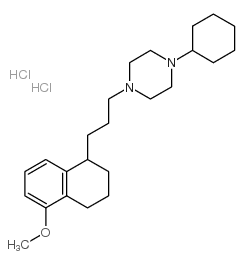
PB28 是一种环己基哌嗪衍生物,是一种 Ki 值为 0.68 nM 的高亲和力和选择性 sigma 2 (σ2) 受体激动剂。PB28 也是一种 σ1 受体拮抗剂,Ki 为 0.38 nM,对其他受体的亲和力较小。PB28 抑制豚鼠膀胱和回肠中的电诱发抽搐,其 EC50 值分别为 2.62 μM 和 3.96 μM。PB28 可以调节 SARS-CoV-2-人之间的蛋白质与蛋白质的相互作用。PB28 可诱导非 caspase 依赖性的细胞凋亡 (apoptosis),并具有抗肿瘤活性。
|
| 相关类别 |
|
| 靶点 |
Ki: 0.68 nM (σ2 receptor); 0.38 nM (σ1 receptor)[4]
|
| 体外研究 |
PB28(15-25nm;24-48小时;MCF7和MCF7-ADR细胞)处理显示MCF7和MCF7-ADR细胞在G0-G1期积累,这些细胞与时间和浓度无关[1]。PB28的σ2受体亲和力(在MCF7和MCF7 ADR细胞中分别为0.28nm和0.17nm)高于σ1受体亲和力(分别为13.0nm和10.0nm)[1]。PB28抑制MCF7和MCF7 ADR细胞的生长,IC50s分别为25nm和15nm,治疗2天后[1]。PB28通过caspase非依赖性途径诱导细胞凋亡[1]。PB28还以浓度和时间依赖性的方式降低P-gp的表达(MCF7中约60%,MCF7 ADR中约90%)[1]。PB28在C6大鼠胶质瘤和SK-N-SH人神经母细胞瘤细胞系中均显示出抗增殖和细胞毒性作用[1]。细胞周期分析[1]细胞系:MCF7和MCF7-ADR细胞浓度:25nm和15nm孵育时间:24小时、48小时结果:MCF7和MCF7-ADR细胞在G0-G1期聚集,具有时间和浓度无关性。
|
| 体内研究 |
PB28(10.7 mg/mL;腹腔注射;每日;持续两周;C57BL/6雌性小鼠)治疗抑制Panc02肿瘤负荷小鼠的肿瘤生长。PB28还为小鼠提供了生存优势[2]。动物模型:C57BL/6雌性小鼠(10周龄)注射Panc02细胞[2]剂量:10.7mg/mL给药:腹腔注射;每日一次;持续两周结果:抑制Panc02肿瘤负荷小鼠的肿瘤生长。
|
| 参考文献 |
[1]. Amalia Azzariti, et al. Cyclohexylpiperazine Derivative PB28, a sigma2 Agonist and sigma1 Antagonist Receptor, Inhibits Cell Growth, Modulates P-glycoprotein, and Synergizes With Anthracyclines in Breast Cancer. Mol Cancer Ther. 2006 Jul;5(7):1807-16. [2]. Maria Laura Pati, et al. Sigma-2 Receptor Agonist Derivatives of 1-Cyclohexyl-4-[3-(5-methoxy-1,2,3,4-tetrahydronaphthalen-1-yl)propyl]piperazine (PB28) Induce Cell Death via Mitochondrial Superoxide Production and Caspase Activation in Pancreatic Cancer. BMC Cancer. 2017 Jan 13;17(1):51. [3]. Nicola A Colabufo, et al. A New Method for Evaluating sigma(2) Ligand Activity in the Isolated Guinea-Pig Bladder. Naunyn Schmiedebergs Arch Pharmacol. 2003 Aug;368(2):106-12. [4]. Francesco Berardi, et al. Exploring the Importance of Piperazine N-atoms for sigma(2) Receptor Affinity and Activity in a Series of Analogs of 1-cyclohexyl-4-[3-(5-methoxy-1,2,3,4-tetrahydronaphthalen-1-yl)propyl]piperazine (PB28). J Med Chem. 2009 Dec 10;52(23):7817-28. [5]. David E Gordon, et al. A SARS-CoV-2-Human Protein-Protein Interaction Map Reveals Drug Targets and Potential Drug-Repurposing. bioRxiv. 2020 Mar 22;2020.03.22.002386.
|