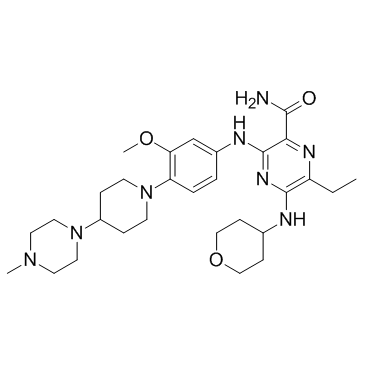
| 描述 |
Gilteritinib 是一种有效的 FLT3/AXL 抑制剂,IC50 分别为 0.29 nM/0.73 nM。
|
| 相关类别 |
|
| 靶点 |
IC50: 0.29 nM (FLT3)[1] IC50: 0.35 nM (LTK), 0.73 nM (AXL), 1.2 nM (EML4-ALK), 230 nM (c-KIT)[2]
|
| 体外研究 |
在测试的78种酪氨酸激酶中,Gilteritinib(ASP2215)在1 nM时抑制FLT3,白细胞酪氨酸激酶(LTK),间变性淋巴瘤激酶(ALK)和AXL激酶超过50%,FLT3的IC50值为0.29 nM,约为800-比c-KIT更有效[1]。在1nM(FLT3,LTK,ALK和AXL)或5nM(TRKA,ROS,RET和MER)的浓度下,Gilteritinib抑制78种测试激酶中的8种的活性超过50%。 FLT3的IC50为0.29nM,AXL的IC50为0.73nM。吉地替尼抑制FLT3的IC50比抑制c-KIT(230nM)所需的浓度高约800倍。针对MV4-11和MOLM-13细胞评估Gilteritinib的抗增殖活性,其内源性表达FLT3-ITD。治疗5天后,Gilteritinib抑制MV4-11和MOLM-13细胞的生长,平均IC50分别为0.92 nM(95%CI:0.23-3.6 nM)和2.9 nM(95%CI:1.4-5.8 nM) 。 MV4-11细胞的生长抑制伴随着FLT3磷酸化的抑制。相对于载体对照细胞,在分别用0.1nM,1nM和10nM Gilteritinib处理2小时后,磷酸化的FLT3水平分别为57%,8%和1%。此外,低至0.1nM或1nM的剂量导致磷酸化ERK,STAT5和AKT的抑制,所有这些都是FLT3活化的下游靶标。为了研究吉替替尼对AXL抑制的作用,用吉替替尼处理表达外源性AXL的MV4-11细胞。在1nM,10nM和100nM的浓度下持续4小时,Gilteritinib处理使磷酸化的AXL水平分别降低38%,29%和22%[2]。
|
| 体内研究 |
在MV4-11异种移植小鼠中,Gilteritinib(ASP2215)在肿瘤中的浓度比用10mg/kg口服吉替替尼4天的血浆中的浓度高20倍以上。吉替替尼治疗28天导致MV4-11肿瘤生长的剂量依赖性抑制,并诱导超过6mg/kg的完全肿瘤消退。此外,Gilteritinib降低了骨髓中的肿瘤负荷并延长了静脉移植MV4-11细胞的小鼠的存活[1]。
|
| 激酶实验 |
使用ATP浓度测试对一组78种测试激酶的吉替替尼的激酶抑制活性,所述ATP浓度近似等于TK-ELISA或片外迁移率变动测定中每种激酶的Km值。最初,测试两种浓度的吉替替尼(1nM和5nM)以评估每种化合物对TK活性的抑制作用。然后使用剂量范围的吉替替尼进行进一步研究以确定激酶的IC 50值,其中用1nM吉替替尼以及c-KIT抑制活性> 50%。 TK-ELISA和MSA测定用于进行FLT3,LTK,AXL和c-KIT的IC50研究;进行HTRF KinEASE-TK测定以评估棘皮动物微管相关蛋白样4-ALK(EML4-ALK)的IC50值[2]。
|
| 细胞实验 |
使用CellTiter-Glo发光细胞存活力测定评估吉替替尼对MV4-11和MOLM-13细胞的作用。进行后续研究以检查吉替替尼和喹喔替尼对表达FLT3-ITD,FLT3-D835Y,FLT3-ITD-D835Y,FLT3-ITD-F691L或FLT3-ITD-F691I的Ba / F3细胞的作用。用DMSO或递增浓度的吉替替尼(0.01,0.1,1,10和100nM)处理MV4-11和MOLM-13细胞5天,并使用CellTiter-Glo测量细胞活力[2]。
|
| 动物实验 |
小鼠[1]在移植了MV4-11 AML细胞的裸鼠中评估抗肿瘤活性。还研究了异种移植小鼠中的药代动力学。用口服10mg / kg的吉替替尼治疗MV4-11异种移植小鼠4天。吉替替尼治疗28天导致MV4-11肿瘤生长的剂量依赖性抑制,并导致完全肿瘤消退超过6 mg / kg [1]。
|
| 参考文献 |
[1]. ASP2215, a novel FLT3/AXL inhibitor: Preclinical evaluation in acute myeloid leukemia (AML). 2014 ASCO Annual Meeting. [2]. Mori M, et al. Gilteritinib, a FLT3/AXL inhibitor, shows antileukemic activity in mouse models of FLT3 mutated acute myeloid leukemia. Invest New Drugs. 2017 Oct;35(5):556-565.
|