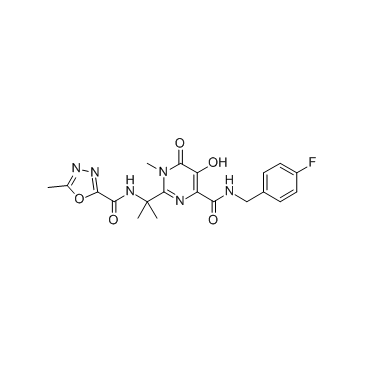
| 描述 |
Raltegravir(MK0518)是HIV整合酶(IN)抑制剂。
|
| 相关类别 |
|
| 体外研究 |
携带S217H取代的PFV IN对Raltegravir的敏感性低10倍,IC50为900 nM。 PFV IN显示10%的WT活性并且被Raltegravir抑制,IC50为200nM,表明与WT IN相比,对IN链转移抑制剂(INSTI)的敏感性降低了两倍。 S217Q PFV IN与Raltegravir一样对WT酶敏感[1]。 Raltegravir通过葡萄糖醛酸化代谢,而不是肝脏代谢。 Raltegravir在人T淋巴细胞培养物中具有有效的抗HIV-1体外活性,95%抑制浓度为31±20 nM。当Raltegravir在CEMx174细胞中进行测试时,Raltegravir对HIV-2也有活性,IC95为6 nM。 Raltegravir代谢主要通过葡糖醛酸化发生。作为葡萄糖醛酸化酶UGT1A1的强诱导剂的药物显着降低了Raltegravir浓度,因此不应使用。 Raltegravir对肝细胞色素P450活性的抑制作用较弱。 Raltegravir不诱导CYP3A4 RNA表达或CYP3A4依赖性睾酮6-β-羟化酶活性[2]。在镁和钙的存在下,Raltegravir细胞渗透性降低[3]。 Raltegravir和相关的HIV-1整合酶(IN)链转移抑制剂(INSTIs有效阻断病毒复制[4]。在急性感染的人类淋巴样CD4 + T细胞系MT-4和CEMx174中,Raltegravir有效抑制SIVmac251复制。 EC90在低纳摩尔范围内[5]。
|
| 体内研究 |
Raltegravir诱导非人灵长类动物的病毒免疫学改善,进行SIVmac251感染。一种非人类灵长类动物在Raltegravir单一疗法后显示出不可检测的病毒载量[5]。
|
| 激酶实验 |
对于定量链转移测定,通过退火HPLC级寡核苷酸5'-GACTCACTATAGGGCACGCGTCAAAATTCCATGACA和5'-ATTGTCATG GAATTTTGACGCGTGCCCTATAGTGAGTC形成供体DNA底物。反应(40μL)含有0.75μMPFVIN,0.75μM供体DNA,4 nM(300 ng)超螺旋pGEM9-Zf( - )靶DNA,125 mM NaCl,5 mMMgSO4,4μMZnCl2,10mM DTT,0.8% (体积/体积)DMSO,和25mM BisTris丙烷-HCl,pH7.45。以指定浓度添加Raltegravir。通过加入在150mM NaCl,2mM DTT和10mM Tris-HCl(pH 7.4)中稀释的2μLPFVIN开始反应,并在37℃加入25mM EDTA和0.5%(wt)后在1小时后停止反应。 / vol)SDS。通过用20μg蛋白酶K在37℃下消化30分钟,然后用乙醇沉淀去蛋白化的反应产物在1.5%琼脂糖凝胶中分离,并通过用溴化乙锭染色显现。使用Platinum SYBR Green qPCR SuperMix和三种引物:5'-CTACTTACTCTAGCTTCCCGGCAAC,5'-TTCGCCAGTTAATAGTTTGCGCAAC和5'-GACTCACTATAGGGCACGCGT,通过定量实时PCR定量整合产物。 PCR反应(20μL)含有0.5μM的每种引物和1μL稀释的整合反应产物。在95℃下进行5分钟的变性步骤后,在CFX96 PCR仪器中进行35个循环,使用95℃变性10秒,在56℃退火30秒和在68℃延伸1分钟。在不存在INSTI的情况下使用WT PFV IN反应的连续稀释产生标准曲线。
|
| 细胞实验 |
用SIVmac251,HIV-1(IIIB)和HIV-2(CDC 77618)原种感染人MT-4细胞2小时,感染复数约为0.1。然后将细胞在磷酸盐缓冲盐水中洗涤三次,并在存在或不存在的情况下,在96孔板中以5×105 / mL悬浮于96孔板中的新鲜培养基(加入50细胞/ mL IL-2的原代细胞)中。一系列一式三份的raltegravir浓度(0.0001μM-1μM)。还制备未经处理的感染和模拟感染的对照,以便比较来自不同处理的数据。当对照病毒感染的细胞培养物中的广泛细胞死亡在显微镜下可检测为缺乏重新聚集的能力时,通过甲基四唑(MTT)方法(MT-4 / MTT测定)定量MT-4细胞中的病毒致细胞病变。感染后MT-4细胞形成簇的能力。简而言之,通过移液来破坏簇;并且,在37℃温育2小时后,通过光学显微镜(100×放大率)评估新簇的形成。收集细胞培养物上清液用于通过ELISA测量HIV-1 p24和HIV-2 / SIVmac251 p27核心抗原。在CEMx174感染的细胞培养物中,其显示形成由病毒包膜糖蛋白诱导的合胞体的倾向,在感染后5天,通过光学显微镜对每个孔以盲法计数合胞体。
|
| 参考文献 |
[1]. Hare, S., et al., Molecular mechanisms of retroviral integrase inhibition and the evolution of viral resistance. Proc Natl Acad Sci U S A, 2010. 107(46): p. 20057-62. [2]. Hicks C, et al. Raltegravir: the first HIV type 1 integrase inhibitor. Clin Infect Dis. 2009 Apr 1;48(7):931-9 [3]. Moss DM, et al. Divalent metals and pH alter raltegravir disposition in vitro. Antimicrob Agents Chemother. 2012 Jun;56(6):3020-6 [4]. Hare S, et al. Structural and functional analyses of the second-generation integrase strand transfer inhibitor dolutegravir (S/GSK1349572). Mol Pharmacol. 2011 Oct;80(4):565-72. [5]. Lewis, M.G., et al. Response of a simian immunodeficiency virus (SIVmac251) to raltegravir: a basis for a new treatment for simian AIDS and an animal model for studying lentiviral persistence during antiretroviral therapy. Retrovirology, 2010. 7: p. 21. [6]. Xu P, et al. Combined Medication of Antiretroviral Drugs Tenofovir Disoproxil Fumarate, Emtricitabine, and Raltegravir Reduces Neural Progenitor Cell Proliferation In Vivo and In Vitro. J Neuroimmune Pharmacol. 2017 Dec;12(4):682-692.
|